Τουλάχιστον οκτώ περιπτώσεις μυοκαρδίτιδας ή καρδιακής φλεγμονής σε παιδιά ηλικίας 5 έως 11 ετών που έκαναν το εμβόλιο Pfizer-BioNTech για τον COVID αναφέρθηκαν στα Κέντρα Ελέγχου και Πρόληψης Νοσημάτων (CDC), ανέφερε η υπηρεσία κατά τη διάρκεια συνάντησης στις 16 Δεκεμβρίου .
Τα κρούσματα αναφέρθηκαν στο Σύστημα Αναφοράς Ανεπιθύμητων Συμβάντων Εμβολίου (VAERS) και παρουσιάστηκαν από έναν υπάλληλο του CDC σε μια ομάδα συμβούλων εμβολίων.
Το CDC αναγνώρισε τις αναφορές την ίδια ημέρα που η Pfizer και η BioNTech ανακοίνωσαν ότι είχαν υποβάλει μια συμπληρωματική Αίτηση Άδειας Βιολογικών Προϊόντων στον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) για να επεκτείνουν την έγκριση του εμβολίου τους Comirnaty — που δεν είναι ακόμη διαθέσιμο στις ΗΠΑ — ώστε να συμπεριλάβει άτομα ηλικίες 12 έως 15 ετών.
Κατά τη συνεδρίαση της 16ης Δεκεμβρίου της συμβουλευτικής επιτροπής εμβολίων του CDC, το CDC είπε ότι είχαν χορηγηθεί περισσότερες από 7 εκατομμύρια δόσεις εμβολίων στην ηλικιακή ομάδα 5 έως 11 ετών τη στιγμή που ο οργανισμός εξέτασε τα δεδομένα, συμπεριλαμβανομένων 5,1 εκατομμυρίων πρώτων δόσεων και 2 εκατομμυρίων δεύτερες δόσεις.
Το CDC είπε ότι υπήρξαν 3.233 αναφορές στο VAERS για ανεπιθύμητες ενέργειες μεταξύ των παιδιών ηλικίας 5 έως 11 ετών, συμπεριλαμβανομένων 14 αναφορών μυοκαρδίτιδας , πέντε αναφορών με παρακολούθηση σε εξέλιξη, εννέα αναφορών με πληροφορίες παρακολούθησης και οκτώ αναφορών μυοκαρδίτιδα που πληρούσε τον ορισμό των περιπτώσεων εργασίας του CDC, συμπεριλαμβανομένων τεσσάρων ανδρών και πέντε γυναικών.
Δύο περιπτώσεις εμφανίστηκαν μετά την πρώτη δόση και έξι περιπτώσεις μετά τη δεύτερη δόση.
Μία έκθεση είναι υπό εξέταση.
Η μυοκαρδίτιδα είναι φλεγμονή του καρδιακού μυός που μπορεί να οδηγήσει σε καρδιακή αρρυθμία και θάνατο.
Σύμφωνα με τον Εθνικό Οργανισμό για Σπάνιες Διαταραχές , η μυοκαρδίτιδα μπορεί να προκληθεί από λοιμώξεις, αλλά «συνηθέστερα η μυοκαρδίτιδα είναι αποτέλεσμα της ανοσολογικής αντίδρασης του οργανισμού στην αρχική καρδιακή βλάβη».
Το CDC είπε ότι τα κρούσματα ήταν ήπια.
Ωστόσο, ο οργανισμός δεν επιβεβαίωσε εάν υπήρχε σχέση μεταξύ των κρουσμάτων μυοκαρδίτιδας και του εμβολίου.
Επίσης, δεν αποκάλυψε το ποσοστό μυοκαρδίτιδας μεταξύ των μη εμβολιασμένων παιδιών αυτής της ηλικιακής ομάδας.
Ο οργανισμός ανέφερε προηγουμένως:
-τα ποσοστά αναφοράς μυοκαρδίτιδας για αγόρια 16 έως 17 ετών μπορεί να είναι περισσότερα από 69 περιπτώσεις ανά εκατομμύριο μετά από δεύτερη δόση, και,
–περίπου 40 περιπτώσεις ανά εκατομμύριο σε αγόρια 12 έως 15 ετών μετά από δεύτερη δόση.
Παρά την πιθανότητα το εμβόλιο να προκαλέσει καρδιακή φλεγμονή, το CDC συνεχίζει να ενθαρρύνει όλους τους γονείς να εμβολιάσουν τα παιδιά τους 5 ετών και άνω κατά του COVID, λέγοντας ότι οι μακροπρόθεσμες επιπτώσεις του ιού υπερτερούν των παρενεργειών του εμβολίου.
«Οι γνωστοί κίνδυνοι της νόσου COVID-19 και οι σχετικές, πιθανώς σοβαρές επιπλοκές, όπως μακροχρόνια προβλήματα υγείας, νοσηλεία, ακόμη και θάνατος, υπερτερούν κατά πολύ των πιθανών κινδύνων εμφάνισης μιας σπάνιας ανεπιθύμητης αντίδρασης στον εμβολιασμό, συμπεριλαμβανομένου του πιθανού κινδύνου μυοκαρδίτιδα ή περικαρδίτιδα», σύμφωνα με το CDC.
Σχολιάζοντας τη συνάντηση της συμβουλευτικής επιτροπής, η παιδίατρος Δρ. Liz Mumper είπε στο The Defender :
«Δεν είδα ότι η επιτροπή εξέτασε το βασικό ζήτημα της ανάλυσης κινδύνου-οφέλους στο οποίο βασίζεται η εγκυρότητα του εκτεταμένου εμβολιασμού στον παιδιατρικό πληθυσμό, δεδομένου του εξαιρετικά χαμηλού ποσοστού θνησιμότητας σε αυτόν τον πληθυσμό και των πιθανών μακροπρόθεσμων επιπτώσεων της μυοκαρδίτιδας, των ανωμαλιών της πήξης. και νευρολογική δυσλειτουργία στα παιδιά.
Δεν είδα να παρουσιάζονται δεδομένα σχετικά με το πώς τα παιδιά συνήθως δεν μεταδίδουν τον COVID-19 στους ευάλωτους, ούτε ηθικά επιχειρήματα σχετικά με το να ζητάμε από τα παιδιά να αναλάβουν μακροπρόθεσμους κινδύνους για την υγεία με την αναπόδεικτη υπόθεση της προστασίας των ηλικιωμένων και των ιατρικά ευάλωτων».
Το CDC συνέστησε να μιλήσετε με τον πάροχο υγειονομικής περίθαλψης ή τον παιδίατρο του παιδιού εάν προκύψουν οποιεσδήποτε ανησυχίες.
Η Pfizer και η BioNTech διεκδικούν 100% προστασία έναντι του COVID για ηλικίες 12 έως 15 ετών
Το αίτημα της Pfizer και της BioNTech την περασμένη εβδομάδα να επεκτείνουν την έγκριση του εμβολίου της Comirnaty ώστε να συμπεριλάβει άτομα ηλικίας 12 έως 15 ετών, ισχυρίζεται ότι το εμβόλιο προσέφερε 100% προστασία έναντι του ιού στην ηλικιακή ομάδα μεταξύ αυτών που έλαβαν δείγμα.
Οι εταιρείες επεσήμαναν τα αποτελέσματα της δοκιμής τους με 2.228 άτομα που κυκλοφόρησαν τον Νοέμβριο, η οποία βρήκε μηδενικά κρούσματα COVID σε πλήρως εμβολιασμένα παιδιά ηλικίας 12 έως 15 ετών, όταν δοκιμάστηκαν επτά ημέρες έως τέσσερις μήνες μετά τη λήψη δεύτερης δόσης του Pfizer- Εμβόλιο BioNTech.
Η Pfizer είπε σε ένα δελτίο τύπου , το προφίλ ανεπιθύμητων ενεργειών ήταν «γενικά σύμφωνο με άλλα κλινικά δεδομένα ασφάλειας για το εμβόλιο, με ένα ευνοϊκό προφίλ ασφάλειας που παρατηρήθηκε σε άτομα με τουλάχιστον έξι μήνες παρακολούθησης ασφάλειας μετά τη δεύτερη δόση».
Προβλήματα με την κλινική δοκιμή της Pfizer σε παιδιά ηλικίας 12 έως 15 ετών
Σύμφωνα με την Canadian COVID Care Alliance (CCCA) — μια ομάδα περισσότερων από 500 ανεξάρτητων Καναδών γιατρών, επιστημόνων και επαγγελματιών υγείας που δεσμεύτηκαν να παρέχουν στο κοινό πληροφορίες βασισμένες σε στοιχεία σχετικά με τον COVID, την αρχική κλινική δοκιμή της Pfizer διάρκειας 12 έως 15 ετών:
“Η ηλικία ήταν πολύ μικρή για να δείξει κίνδυνο και δεν έδειξε κανένα όφελος — μόνο 1.005 συμμετέχοντες εμβολιάστηκαν και 978 έλαβαν εικονικό φάρμακο”.
Η Pfizer σημείωσε εξαιρετικά αποτελέσματα κατά τη διάρκεια της κλινικής δοκιμής, αλλά οι έφηβοι που δοκίμασαν διέτρεχαν στατιστικά 0% κίνδυνο θανάτου από COVID, επομένως η λήψη του εμβολίου δεν θα τους είχε ωφελήσει εξαρχής, είπε η CCCA.
Αυτό που έκανε το εμβόλιο ήταν να αυξήσει τον κίνδυνο ανεπιθύμητων ενεργειών , τα οποία η κλινική δοκιμή δεν είχε σχεδιαστεί για να ανιχνεύσει.
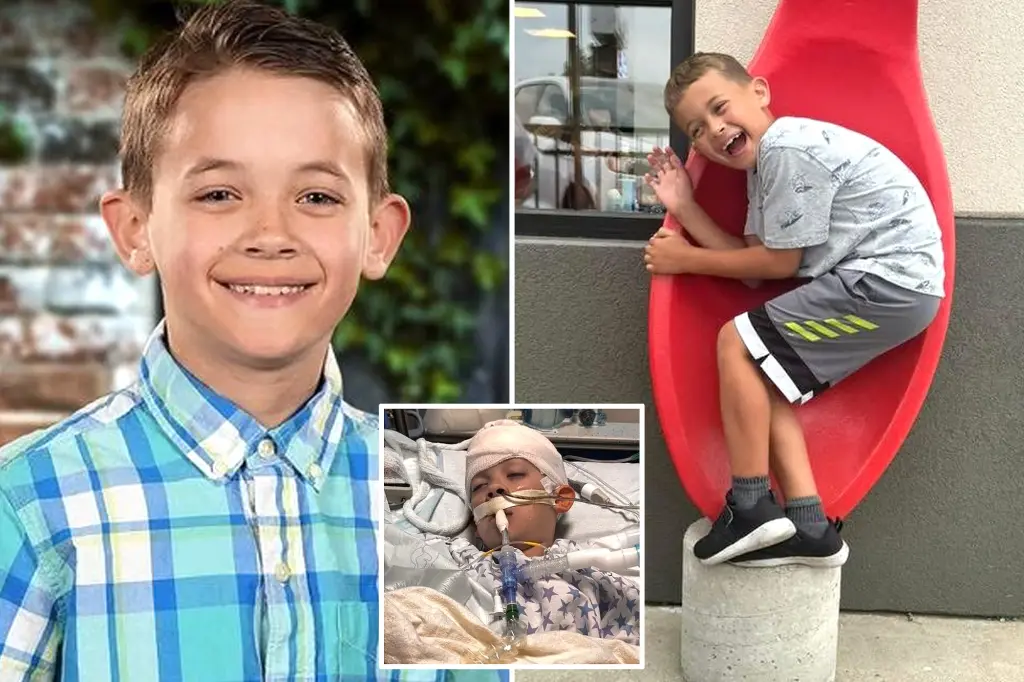
Υπήρξε τουλάχιστον ένα πολύ σοβαρό ανεπιθύμητο συμβάν κατά τη διάρκεια της κλινικής δοκιμής 12 έως 15 — η Maddie de Garay , ένα 12χρονο κορίτσι από το Οχάιο.
«Η Maddie ανέπτυξε γαστροπάρεση, ναυτία και έμετο, ακανόνιστη αρτηριακή πίεση, απώλεια μνήμης, ομίχλη εγκεφάλου, πονοκεφάλους, ζάλη, λιποθυμία, επιληπτικές κρίσεις, λεκτικά και κινητικά τικ, προβλήματα εμμηνορροϊκού κύκλου, απώλεια αίσθησης από τη μέση και κάτω, απώλεια ελέγχου του εντέρου και της ουροδόχου κύστης και είχε .
Τοποθετήθηκε ρινογαστρικός σωλήνας επειδή έχασε την ικανότητά της να τρώει», είπε η CCCA .
«Τους τελευταίους 10 μήνες, βρισκόταν σε αναπηρικό καροτσάκι και τρέφεται με σωλήνα».
Στην έκθεση της Pfizer, η ανεπιθύμητη ενέργεια του de Garay περιγράφηκε ως «λειτουργικός κοιλιακός πόνος».
Η Pfizer συνεχίζει να διαφημίζει το εμβόλιο της ως ασφαλές και αποτελεσματικό, αλλά λείπουν δεδομένα και μάλιστα παραδέχονται ότι η κλινική δοκιμή της ήταν πολύ μικρή για να ανιχνεύσει σπάνιες παρενέργειες, ανέφερε η CCCA.
Η Pfizer άλλαξε τη φόρμουλα εμβολίου Pfizer-BioNTech
Ο FDA ενέκρινε στις 29 Οκτωβρίου την Άδεια Χρήσης Έκτακτης Ανάγκης (EUA) του εμβολίου Pfizer-BioNTech για τον COVID για παιδιά ηλικίας 5 έως 11 ετών, ενώ ταυτόχρονα υπέγραψε μια νέα φόρμουλα — που περιέχει τρομεθαμίνη (Tris) — χωρίς να έχει ολοκληρωθεί κλινικές δοκιμές σε ζώα ή ανθρώπους για την αξιολόγηση της ασφάλειας ή της αποτελεσματικότητας.
Ο FDA εξέτασε μόνο τις «αναλυτικές αξιολογήσεις συγκρισιμότητας» της Pfizer για να αξιολογήσει εάν τα σκευάσματα εμβολίου της Pfizer για τον COVID που περιέχουν Tris και ρυθμιστικά διαλύματα φυσιολογικού ορού ρυθμισμένου με φωσφορικά (PBS) ήταν «αναλυτικά συγκρίσιμα».
Η Pfizer είπε ότι «η αλλαγή στο ρυθμιστικό διάλυμα δεν θεωρείται κλινικά σημαντική» και χρησιμοποιείται για την απλοποίηση της χορήγησης και την αύξηση του χρόνου αποθήκευσης σε φαρμακευτικά προϊόντα.
Η νέα φόρμουλα εγκρίνεται για χρήση έκτακτης ανάγκης σε άτομα 5 έως 11 ετών και σε άτομα ηλικίας 12 ετών και άνω, σύμφωνα με την επιστολή εξουσιοδότησης EUA (LOA) της Pfizer-BioNTech EUA που επανεκδόθηκε από τον FDA στις 29 Οκτωβρίου.
Ωστόσο, το εμβόλιο Comirnaty δεν υπόκειται σε αλλαγή της φόρμουλας .
Το εμβόλιο Pfizer-BioNTech μπορεί να περιέχει ρυθμιστικό διάλυμα phos ή tris — το οποίο δεν χρησιμοποιήθηκε σε καμία από τις κλινικές δοκιμές.
Το εμβόλιο Comirnaty περιέχει το ρυθμιστικό διάλυμα PBS.
Το εμβόλιο Comirnaty της Pfizer για τον COVID εγκρίθηκε πλήρως από τον FDA για άτομα ηλικίας 16 ετών και άνω τον Αύγουστο, αν και δεν είναι ακόμη διαθέσιμο στις ΗΠΑ .
Η Pfizer’s Comirnaty είναι το μόνο εμβόλιο COVID που έχει λάβει πλήρη έγκριση από τον FDA .
Η πλήρης έγκριση σημαίνει ότι οι εταιρείες θα μπορούν να συνεχίσουν να παράγουν το εμβόλιο μετά το πέρας της πανδημίας COVID και θα τους επιτραπεί να διαθέσουν στην αγορά το προϊόν, ανέφερε το Forbes .
Ανοίγει επίσης το δρόμο για την επιβολή εμβολίου κατά του COVID για την ηλικιακή ομάδα 12 έως 15 ετών και επηρεάζει κατά πόσο η φαρμακευτική εταιρεία μπορεί να θεωρηθεί υπεύθυνη για τις βλάβες που προκαλούνται από το προϊόν της.